您是否真正符合 21CFR Part11 的要求?

我猜现在传言是真的了,FDA 最近(2015 年末)宣布将开始更严格的检查,以符合 21 CFR 第 11 部分的规定,这些规定涉及电子记录、元数据审计跟踪、需要真实可信的签名以及产品验证。
因此,作为选择冷链监控解决方案的客户,如何才能确保所购买的产品符合该法规的要求呢?
在选择产品前,您需要向潜在的解决方案供应商询问一些简单的问题,了解他们的产品、处理收集和存储数据的方式,以及他们是如何验证这些产品以确保其符合要求的。
假定您选择的是简单的 “去/不去 “设备,那么询问 “原始出车记录 “中的数据是否可以发送到云数据库或其他数据存储解决方案中始终是合适的,这样出车数据就可以以安全模式(如加密的 PDF 文件,可防篡改)进行审计。许多 “去/不去 “指示器设备不提供检索原始行程记录的选项,因此这些设备不符合要求,您也不符合要求!
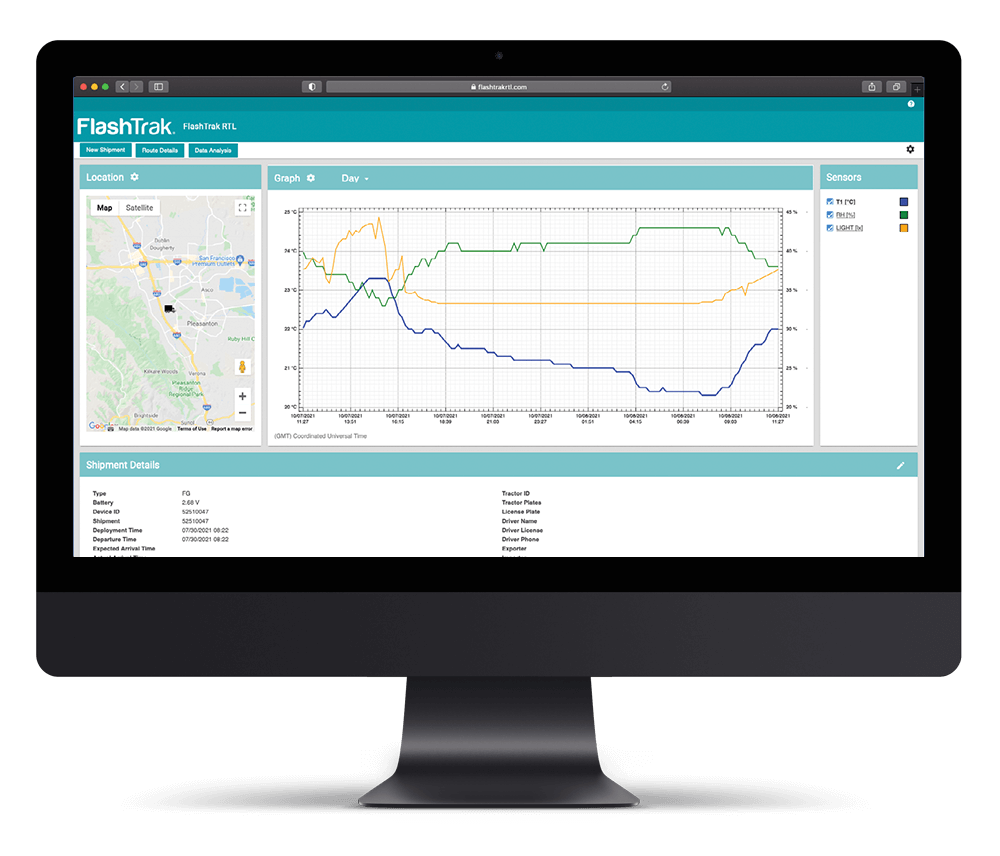
就数据记录仪而言,大多数型号的数据记录仪都带有存储器,而不仅仅是 “去/不去 “设备,这些数据记录仪可以直接加载到计算机 USB 上生成 PDF 报告,或者将记录仪连接到预先加载了应用程序的计算机设备上下载数据以生成 PDF 报告。
不过,重要的是要询问 PDF 文件是否为加密格式,无法进行篡改,并能显示所有路线数据,包括用于创建文件的元数据。这将确保合规性,并符合与 USP 条例 1079 相关的标准,以防止篡改,同时也符合 21 CFR Part11 的合规准则。
需要注意的是,不仅记录仪要符合这些数据安全性、完整性和验证要求的标准,而且用于存储这些数据的任何云数据库或其他形式的数据库也必须符合 21 CFR 第 11 部分关于跟踪更改、审计跟踪、签名合规性和验证等方面的要求。
市场上有如此多的数据记录器产品,而且需要确保您购买的产品符合所有相关法规(不仅是国内法规,而且是全球法规),作为客户,您需要询问这些重要问题,以避免在审核时出现任何不合规问题。
DeltaTrak 为生命科学、食品和农产品行业提供符合行业法规的产品已有 26 年的历史。我们已经接受了许多大型制药公司的审核,每次审核都没有出现重大的不合规问题。